Alimentación
Conoce la rutina de baile asiático para adelgazar

Si eres fan de TikTok seguramente haz visto la rutina de baile asiático ideal para adelgazar, es por eso que...
 Qué es un embarazo críptico: mujeres que dan...
Qué es un embarazo críptico: mujeres que dan...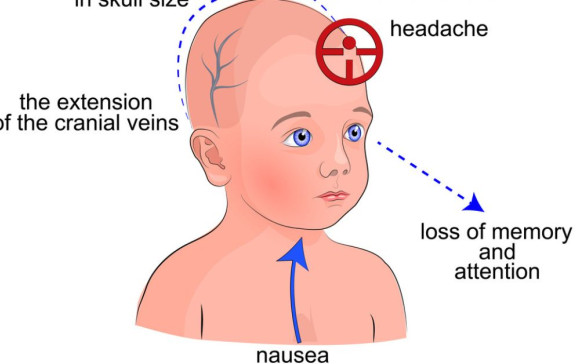 Parálisis cerebral infantil: causas y cómo se puede...
Parálisis cerebral infantil: causas y cómo se puede... Toros mecánicos: ¿qué riesgos hay al caer de...
Toros mecánicos: ¿qué riesgos hay al caer de... Cómo hacer té de cáscara de huevo para...
Cómo hacer té de cáscara de huevo para...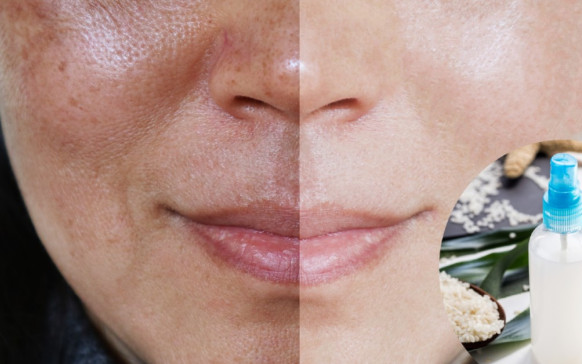 Elimina las manchas, hidrata y rejuvenece la piel:...
Elimina las manchas, hidrata y rejuvenece la piel:... Qué causa la colitis: 4 remedios naturales para...
Qué causa la colitis: 4 remedios naturales para...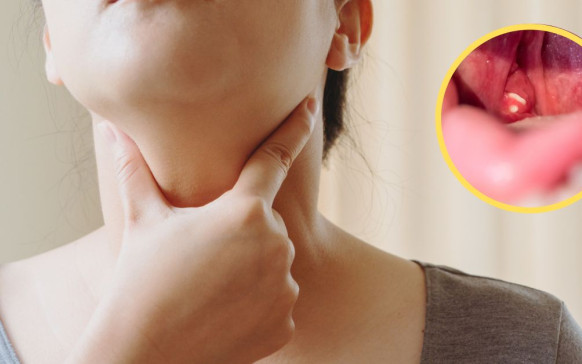 Qué pasa si te quitan las amígdalas: ¿no...
Qué pasa si te quitan las amígdalas: ¿no...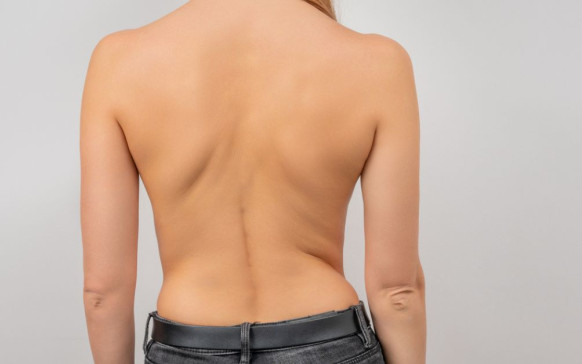 Escoliosis: qué es y cuáles son sus síntomas
Escoliosis: qué es y cuáles son sus síntomas